04.05.2023
Analytik und Nachhaltigkeit - Einfache Versuche, die Kinder und Jugendliche nachdenklich stimmen
Mojgan Czernik, Prof. Volker Wiskamp , Hochschule Darmstadt
Wolfgang Proske, Schulchemiezentrum
Unsere Welt ist ein riesiges Ökosystem; alles hängt mit allem zusammen. Die Analytische Chemie hilft dabei, einzelne Bestandteile darin zu erkennen und die Zusammenhänge zu verstehen - ein wichtiges Bildungsziel im Rahmen der Nachhaltigkeitsagenda 2030 der Vereinten Nationen [1]. Ein weiteres Ziel ist nachhaltige Gesundheit; dazu gehört Hygiene. Die Analytische Chemie kann Stoffe aufspüren, die Krankheitskeime anziehen, und deshalb warnen.
Wenn Stoffe ins Wasser oder in die Luft gelangen, sind sie nicht "aus den Augen, aus dem Sinn", sondern verteilen sich (global) und können irgendwann irgendwo Reaktionen zu neuen Stoffen eingehen oder biologische Veränderungen bewirken, die eventuell gefährlich für Mensch und Umwelt sind. Diese Stoffe und ihre Reaktionsprodukte identifiziert die Analytische Chemie.
Schließlich gilt das Ersatzstoffprinzip, das besagt, dass Prozesse, bei denen gefährliche Stoffe eingesetzt werden, mit harmloseren Chemikalien durchgeführt werden müssen, wenn dies möglich ist, um das gewünschte Ziel zu erreichen. Dies wird im vorliegenden Beitrag am Beispiel des Alken-Nachweises durch Bromierung demonstriert, dass dafür hochgefährliches elementares Brom überhaupt nicht nötig ist und die Chemie durchaus etwas "grüner" sein kann [2].

- Abb.1: Schülerarbeitsplatz zur Herstellung
von Margarine. Im Becherglas rechts
ist das Endprodukt [3].
Das Ganze ist mehr als seine Teile

von Margarine. Im Becherglas rechts
ist das Endprodukt [3].
Alle Grundschüler kennen Margarine, wissen aber meistens nicht, dass dieses Lebensmittel ein komplexes Stoffgemisch ist. Also lassen wir sie selbst Margarine herstellen: 50 g Kokosfett, 20 ml Sonnenblumenöl, 8-9 ml Milch, 8-9 ml Wasser, eine Messerspitze Salz, ein Teelöffel Mehl und ein Eigelb werden heiß gemischt und dann im Eisbad unter Rühren abgekühlt, bis eine pastöse Masse resultiert (Abbildung 1). Die Margarine enthält Fett, ist aber mehr als Fett. Sie enthält Salz, ist aber mehr als Salz. Sie enthält Wasser, ist aber mehr als dieses ...
Nun wissen die Schüler, woraus Margarine besteht - sie haben sie ja aus ihren Grundbausteinen synthetisiert. Kann man die Margarine auch wieder in ihre Ausgangsstoffe zerlegen? Das ist schwieriger. Exemplarisch lassen wir die Kinder beweisen, dass die Margarine Fett bzw. Öl enthält. Dazu zerreiben sie einen Teelöffel von ihrem Erzeugnis in einer Reibschale mit Petrolether (oder Wundbenzin aus der Apotheke).
Darin löst sich etwas von dem ursprünglichen Kokosfett und Sonnenblumenöl, wie die Kinder noch sehen werden. Wenn Sie nämlich die Benzinphase, den Extrakt, vorsichtig mit einer Pipette abziehen, in eine Porzellanschale geben und das Lösungsmittel (unter dem Abzug oder draußen) verdampfen lassen, bleibt ein öliger Film zurück, der sich schmierig anfühlt. Alternativ können sie den Extrakt auf Filterpapier gegeben, wovon er aufgesaugt wird, das Lösungsmittel sehr rasch verdampft und ein Fettfleck auf dem Papier zurückbleibt (Abbildung 2).

- Abb.2: Fettfleck-Probe; Abb.3: Zerreiben von
Sonnenblumenkernen zur Vorbereitung der
Extraktion mit Petrolether; Abb.4: Papier-
chromatographie: Trennung der Farbstoffe
zweier verschiedener schwarzer Filzstifte [3]
Und wo kommt das Kokosfett her? Na klar, aus der Kokosnuss. Also werden getrocknete Kokosflocken mit Petrolether zerrieben; wieder ist die Fettfleck-Probe positiv - und ein ökologisches Prinzip wiederholt sich, denn auch die Kokosnuss ist ein komplexes biologisches Produkt und viel mehr als nur ihr Fett.
Die anderen Bestandteile der Margarine kann man auch voneinander trennen und identifizieren und quantifizieren. Das wäre im Sachunterricht der Grundschule aber zu kompliziert und wird auf das Studium der Analytischen Chemie verschoben. Mit den Kindern, durchaus auch schon mit vier- bis sechsjährigen im Kindergarten, wenden wir uns einem anderen Produkt zu, und zwar der wasserlöslichen schwarzen Farbe einiger Filzschreiber.
Die Jungforscher halten es manchmal für Zauberei, wenn aus einem schwarzen Kreis, der um ein ca.1 Zentimeter breites Loch in der Mitte eines Rundfilterpapiers gezogen wurde, über einen gerollten Papierdocht Wasser auf das Filterpapier gesaugt wird und dann phantastische bunte Bilder entstehen (Abbildung 4). Den Kindern wird bewusst, dass sie einer Täuschung aufgesessen sind, denn das Schwarz des Filzschreibers ist keine einheitliche Farbe, sondern eine Farbmischung - ähnlich wie die Margarine eine Stoffmischung ist. Das Schwarz enthält Blau, ist aber mehr als Blau; es enthält Grün, ist aber mehr als Grün ... erst die Mischung der einzelnen Farben bewirkt den Gesamteindruck Schwarz. Welch ein Erkenntnisgewinn!
Den älteren Grundschülern kann man schon erklären, dass sie soeben die Urform der Chromatographie kennengelernt haben - ein analytisches Trennverfahren, welches darauf beruht, dass sich die einzelnen Farbstoffe unterschiedlich gut im Wasser (mobile Phase) lösen und mit diesem transportiert werden bzw. sich unterschiedlich stark am Papier (Cellulose, stationäre Phase) festhalten und deshalb voneinander getrennt und sichtbar gemacht werden können.
Alles hygienisch?
Bei der Margarine-Herstellung haben die Kinder unter anderem etwas Mehl verwendet. Dieses enthält Stärke, die sich mit Iod nachweisen lässt. Hierzu wird zunächst ein Übungsversuch durchgeführt. Reine Stärke wird in heißem Wasser gelöst; nach dem Abkühlen wird ein Tropfen wässrige Iod/Kaliumiodid-Lösung zugetropft. Zur Herstellung werden 1 g Iod und 2,5 g Kaliumiodid im trockenen Zustand gemischt, durch langsames Zugeben von Wasser in Lösung gebracht und die Lösung mit destilliertem Wasser auf ein Gesamtvolumen von 300 ml aufgefüllt; alternativ kann eine in der Apotheke rezeptfrei erhältliche Betaisodona®-Lösung verwendet werden, die einen Anlagerungskomplex von Iod an Polyvinylpyrolidon enthält.

- Abb.5: Kartoffelstärken-Nachweis mit Iod [3]
Es bilden sich tiefblaue Schlieren, und beim Umrühren färbt sich die ganze Lösung dunkelblau - ein sehr empfindlicher Nachweis, der selbst bei kleinen Konzentrationen des Polysaccharids positiv ausfällt. Wenn die Stärke aber nicht ganz rein ist und/oder ihre Lösung nicht frisch zubereitet wurde, ist die Farbe bei der Nachweisreaktion eher dunkelbraun, z.B. wenn man eine Scheibe einer ungekochten Kartoffel mit Iod-Lösung beträufelt (Abbildung 5).
Stärke ist in vielen Lebensmitteln enthalten und bleibt nach dem Essen, wenn das Geschirr nicht ordentlich gespült wurde, zumindest in Spuren daran hängen und zieht mit der Zeit Kleinstlebewesen wie Bakterien oder Pilze an, die eventuell Krankheiten verursachen können.
Für diese Problematik mangelnder Hygiene können Grundschüler durch folgendes Experiment sensibilisiert werden. Sie sollen etwas Kartoffelpüree von einem kleinen Teller oder aus einer kleinen Schale essen und das Geschirr anschließend im Spülbecken abspülen. Dann werden auf jeden Teller bzw. in jede Schale 2-3 Tropfen Iod-Lösung gegeben. Es wird leicht geschwenkt, sodass möglichst alle Geschirrteile benetzt werden. In manchen Fällen tritt eine Dunkelfärbung auf - ein eindeutiger Beweis, dass restliche Stärke vorliegt, welche die Kinder nicht sorgfältig genug abgespült haben. Die Iod/Stärke-Reaktion kann also zur nachhaltigen Gesundheitserziehung beitragen.
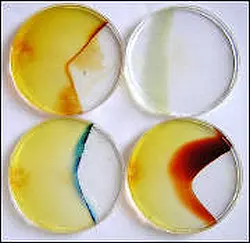
- Abb.6: Chemische Reaktionen nach
Diffusion von Stoffen in der Petrischale [3]
(Globale) Stoffverteilung

Diffusion von Stoffen in der Petrischale [3]
Im Chemieunterricht lernen die Schüler einige Nachweisreaktion kennen, indem sie üblicherweise die Lösungen zweier Stoffe A und B in einem Reagenzglas oder auf einer Tüpfelplatte (vgl. [4]) mischen und dann eine Farb- und/oder Fällungsreaktion beobachten.
Wir führen die Reaktionen anders durch. Und zwar füllen die Jugendlichen eine Petrischale mit destilliertem Wasser und lassen sie ruhig auf einer weißen Unterlage (oder auf einem Overhead-Projektor, sodass die ganze Klasse das Vorgehen mitverfolgen kann) stehen.
Wenige Millimeter vom linken Rand entfernt geben die Experimentatoren wenige Kristalle einer Verbindung A vorsichtig ins Wasser, sodass keine Wellen entstehen; und analog geben sie wenige Millimeter vom rechten Rand entfernt einige Kristalle einer Verbindung B ins Wasser.
Die Stoffe A und B lösen sich im Wasser auf und diffundieren dann von ihrem Eintragungsort mehr oder weniger schnell in die ganze Petrischale hinein. Irgendwann (in der Regel nach wenigen Minuten) treffen sich die von links kommenden Teilchen A mit den von rechts kommenden Teichen B und reagieren miteinander, was an einer Farbänderung und/oder Niederschlagsbildung zu beobachten ist und faszinierend aussieht (Abbildung 6).
Reaktionsgleichungen zu Abbildung 6:
Oben links: Eisen(III)-chlorid und Natriumhydroxid
FeCl3 + 3 NaOH → Fe(OH)3 (rostbrauner Niederschlag) + 3 NaCl
Oben rechts: Eisen(II)-sulfat und Natriumhydroxid
FeSO4 + 2 NaOH → Fe(OH)2 (gräulicher Niederschlag) + Na2SO4
Unten links: Eisen(III)-chlorid und Kaliumhexacynoferrat(II)
FeCl 3 + K4[Fe(CN)6] → K[FeIIIFeII(CN)6] (tiefblaues Kolloid) + 3 KCl
Unten rechts: Eisen(III)-chlorid und Kaliumthiocyanat
FeCl3 + 3 KSCN → Fe(SCN)3 (roter, löslicher Farbkomplex) + 3 KCl
Über die Besprechung der Reaktionsgleichungen und Farbphänomene hinaus, geben wir den qualitativen Nachweismethoden folgend symbolische ökologische Interpretation. Stoffe, die einmal in ein natürliches Gewässer gelangt sind, verteilen sich ins Grundwasser oder über die Flüsse ins Meer, in die Ozeane, und es ist nur eine Frage der Zeit, wann sie geeignete Reaktionspartner finden oder bestimmte biologische Prozesse auslösen.
So wurde DDT (Dichlordiphenyltrichlorethan), das in vielen Ländern gegen die Malaria-übertragende Anopheles-Mücke gespritzt wurde, schließlich im Fettgewebe der Pinguine in der Antarktis nachgewiesen, obwohl das Insektizid dort nie eingesetzt wurde. (Wozu auch? Dort wachsen ja keine Pflanzen.) Oder Nitrate und Phosphate, die im mittleren Westen der USA in großen Mengen zum Düngen der schier unendlichen Monokulturen verwendet wurden, gelangten durch Bodenauswaschungen in den Mississippi und mit ihm in den Golf von Mexiko, bewirkten dort eine Eutrophierung des Meeres, so dass dieser Bereich zu einer der größten Totzonen auf der Erde wurde.
Für Stoffe, welche in die Luft gelangen, gilt Analoges. Schwefeldioxid aus Braunkohlekraftwerken, die ohne Abgaswäsche betrieben wurden, verteilte sich in der Atmosphäre, ließ sich vom Wind oft tausende Kilometer weit treiben und fiel schließlich als schwefelsaurer Regen wieder auf die Erde - an einer anderen Stelle als an seinem Freisetzungsort. Oder Dichlordifluormethan, welches in den 1980er Jahren aus einer Spraydose oder einem defekten Kühlschrank ausgetreten war, brauchte ein paar Monate, um in 30 Kilometer Höhe über die Antarktis zu gelangen, und zerstört dort fotochemisch die Ozonschicht, die sich bis heute nicht ganz davon erholt hat.
Unsere Schüler nehmen aus dieser Unterrichtseinheit als übergeordnetes Lernziel mit, dass Stoffe, die einmal im Fließwasser oder in der Luft sind, der menschlichen Kontrolle entzogen sind. Falls es sich um potenzielle Gefahrstoffe handelt, darf dies nicht geschehen, sondern müssen die Stoffe bereits an ihrem Entstehungsort fachgerecht aufgearbeitet werden.
Weniger gefährlich
Im Oberstufenunterricht steht u.a. das Thema Bromierung von Alkenen als Beispiel für eine elektrophile Additionsreaktion an: Bildung eines Bromoniumions als Zwischenstufe und dessen Rückseitenangriff durch ein Bromidion, sodass ein vicinales Dibromalkan resultiert. Ein hübscher Reaktionsmechanismus. Der Versuch dazu ist auch eindrucksvoll. Ein flüssiges Alken, beispielsweise Cyclohexen, wird im Reagenzglas mit einem Tropfen flüssigem Brom versetzt. Dessen Entfärbung belegt das Vorliegen einer C-C-Doppelbindung. (Negativ-Kontrolle z.B. mit Petrolether, der nur Alkane enthält.) Eine aussagekräftige Nachweisreaktion - aber, so durchgeführt, auch ausgesprochen gefährlich. Wehe, wenn dem Experimentator ein Tropfen Brom auf die Haut kommt. Und wenn die Vorratsflasche mit Brom umfällt, was in der Vergangenheit passiert ist, muss das Gebäude geräumt werden, die Feuerwehr hat viel Arbeit, und der Pressebericht verdirbt den Ruf der Schule - und der Chemie.
Kann das Lernziel "Nachweis eines Alkens durch elektrophile Bromierung" nicht auch auf eine weniger gefährliche Art und Weise erreicht werden? Diese Frage muss sich die lehrende Person stellen, ja, sie ist im juristischen Sinn sogar zu einer Ersatzstoffprüfung verpflichtet.
Deutlich weniger gefährlich ist die Nachweisreaktion bereits, wenn zu dem zu prüfenden Stoff nicht flüssiges Brom, sondern Bromwasser hinzugefügt wird und dieses nach leichtem Schütteln zur Durchmischung der organischen und der wässrigen Phase entfärbt wird. Das Bromwasser wird üblicherweise hergestellt, indem in einer dunklen Flasche (Lichtschutz) eine kleine Menge flüssigen Broms mit Wasser überschichtet wird. Mit der Zeit sättigt sich dieses mit dem Halogen und kann mit einer Pipette für den Nachweisversuch entnommen werden. Man braucht aber immer noch flüssiges Brom als Ausgangsmaterial für das Bromwasser, wenn auch weniger. Das ist schon ein Fortschritt, doch runterfallen darf die Vorratsflasche auch nicht.
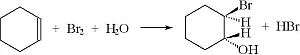
- Abb.7: Alken-Nachweis mit wässriger Brom-Lösung [5].
Kann man ganz auf flüssiges Brom im Chemiekabinett und im Unterricht verzichten? Ja. Wenn man auf eine Bromat/Bromid-Lösung (2,5 g Natriumbromat und 25 g Natriumbromid im Maßkolben mit Wasser zu 1 l lösen) zurückgreift [5]. Eine derartige Lösung ist auch als Maßlösung für die Bromatometrie, einem Redox-Titrationsverfahren, im Chemikalienhandel erhältlich. Die beiden Salze sind im neutralen und alkalischen Medium nebeneinander stabil, und die Lösung ist lange haltbar. Beim Ansäuern mit Schwefelsäure (2 Tropfen konzentrierte Säure auf 10 ml Bromat/Bromid-Lösung) bilden sich Bromsäure, HBrO3, und Bromwasserstoffsäure, HBr, die zu elementarem Brom synproportionieren, sodass Bromwasser entsteht, erkennbar an seiner Gelbbraun-Färbung. Dann hat man das Reagenz, das man für den Alken-Nachweis benötigt.
Die Toxikologie macht ständig Fortschritte und hat mittlerweile das Natriumbromat als kanzerogen eingestuft, sodass es im Schulunterricht nicht mehr verwendet werden darf. Es kann aber auf Natriumhypochlorit umgestiegen werden [6]. Dazu wird zunächst eine schwefelsaure Kaliumbromid-Lösung hergestellt, indem man 5,95 g Kaliumbromid in 200 ml destilliertem Wasser löst und mit 15 ml konzentrierter Schwefelsäure versetzt (HBr-Bildung). Nach dem Abkühlen wird mit Wasser auf ein Gesamtvolumen von 500 ml aufgefüllt. 10 ml dieser Lösung werden mit 1,0 ml 0,6%iger Natriumhypochlorit-Lösung (die handelsübliche Chlorbleichlauge, w = 12,5 %, wird entsprechend mit Wasser verdünnt) versetzt. Das Natriumhypochlorit reagiert mit der Schwefelsäure zur Hypochlorigen Säure, die das Bromid zu Brom oxidiert, wonach man das charakteristisch gefärbte Bromwasser hat.
Oberstufenschülern kann man es zutrauen, diese hier beschriebene Entwicklung eines sehr gefährlichen Nachweis-Experiments zu einer deutlich weniger gefährlichen und im Unterricht praktikablen Variante nachzuvollziehen. Damit wird ihnen ein Prinzip der Green Chemistry transparent, die Chemie auf der Basis von chemischem Sachverstand etwas "grüner" zu machen (vgl. [7]).
Wirklich "grün" ist der Versuch natürlich nicht. Denn die Chlorbleichlauge ist immerhin noch ein starkes Oxidationsmittel, das u.a. zur Desinfektion von Schwimmbädern verwendet wird. Zudem ist das Produkt der Nachweisreaktion eine bromorganische Verbindung, die nicht einfach in den Ausguss geschüttet werden darf, sondern als Sonderabfall gesammelt und einem professionellen Entsorger übergeben werden muss. Und eventuell übrig gebliebenes Bromwasser darf nicht einfach weggeschüttet werden, sondern muss vorab durch Zutropfen von Natriumthiosulfat-Lösung (w = 5 %) reduktiv entfärbt und entgiftet werden.
Auch diese Aspekte sind für die Jugendlichen lehrreich und stärken ihr Bewusstsein zum verantwortungsvollen Umgang in der Chemie.
- Abb.8: Ölsäure ist ein Bestandteil von Pflanzenölen.
Diese gefahrlosen Haushaltsprodukte eignen sich, um den
Alken-Nachweis durch Bromierung kennenzulernen.
Literatur
- Deutsche Bundesregierung: Globale Nachhaltigkeitsstrategie - Nachhaltigkeitsziele verständlich erklärt.
- P. T. Anastas, J. C. Warner: Green Chemistry - Theory and Practise. - Oxford University Press, New York 1998 (als Paperback 2000)
- V. Wiskamp: Naturwissenschaftliches Experimentieren - nicht erst ab Klasse 7. - 3. Aufl. (inkl. CD-ROM), Shaker Verlag, Aachen 2008
- W. Proske, V. Wiskamp: Tüpfelnachweise und Mikrotitrationen im ökologisch orientierten Chemieunterricht. - Analytik News, 16.03.2023;
- W. Proske, V. Wiskamp: Tipps und Tricks für einen gefahrlos(er)en Chemieunterricht. - Aulis Verlag Deubner, Köln 2008, Kap. 5.1
- W. Proske, E. Werner, J. Friedrich: Herstellung von Bromwasser ohne Bromat. - CHEMKON 26 (2019), Nr. 4, S. 165-168
- M. Ben Hamouda, S. A. Motamedian, V. Wiskamp: 25 Jahre "Green Chemistry" - Würdigung des wegweisenden Lehrbuches von Paul T. Anastas und John C. Warner. - Chemie in Labor und Biotechnik (CLB) 74 (2023), Heft 7-8, im Druck
Mojgan Czernik studiert Chemische Technologie an der Hochschule Darmstadt. Teile der vorliegenden Publikation stammen aus ihrer Bachelorarbeit.
