22.06.2023
Ausbeute, Atomökonomie, Umweltfaktor - Analytische Daten und deren ökologische Bewertung
Sara Anna Motamedian, Prof. Volker Wiskamp , Hochschule Darmstadt
Um eine chemische Umsetzung beurteilen zu können, müssen zunächst die Mengen und Reinheitsgrade der Ausgangsstoffe und Hilfsmittel (u.a. Lösungsmittel, Katalysatoren) bekannt sein. Die Reinheitsgrade zu ermitteln, ist eine Aufgabe der analytischen Qualitätskontrolle.
Am Ende der Umsetzung liegen Produkte vor, die voneinander getrennt werden. Mit Hilfe analytischer Methoden wird dann aufgeklärt, um welche Stoffe (Hauptprodukte, Nebenprodukte und Abfälle) es sich handelt und in welchem Mengenverhältnis sie vorliegen.
Auf Basis der analytischen Daten wird abschließend eine Reaktionsgleichung aufgestellt, und es werden Berechnungen der Ausbeute, der Atomökonomie und des Umweltfaktors vorgenommen, die als Kriterien für die Effizienz einer Synthese herangezogen werden können, was aber auch seine Grenzen hat, wie im Folgenden geschildert wird.
Green Chemistry
Ein zentrales Ziel eines Chemiestudiums ist es, den Studierenden zu vermitteln, dass chemische Synthesen so "grün wie möglich" konzipiert und durchgeführt werden müssen [1].
Im ersten Fachsemester lernt man traditionell auch das Chemische Rechnen. Neben dem korrekten Aufstellen von Reaktionsgleichungen spielen dabei Begriffe wie Massenwirkungsgesetz, Stoffmenge, Massenanteil ... eine wichtige Rolle. Präparative Laborübungen enden üblicherweise mit der Berechnung der Ausbeute eines Produktes.
Ist die Ausbeute ein Kriterium für die Effizienz der Synthese oder eher eins für das experimentelle Geschick der Praktikantin bzw. des Praktikanten und dann ein Maß für die Notengebung? Parameter wie Atomökonomie oder Umweltfaktor werden selten berechnet, was aber geschehen sollte und wozu wir im Folgenden ermutigen möchten.
Wenn man zwei verschiedene Synthesen für ein Produkt miteinander vergleicht, gilt diejenige mit der höheren Ausbeute, der höheren Atomökonomie und dem niedrigeren Umweltfaktor als die "grünere" Synthese. Aber Vorsicht. Parameter ausrechnen kann man immer, doch für eine Gesamtbeurteilung müssen noch andere Faktoren hinzugezogen werden: insbesondere toxikologische und sicherheitstechnische Daten, Verwertbarkeit von Nebenprodukten, Recycling von Hilfsstoffen, Abfallentsorgung, Verfügbarkeit von Ausgangsstoffen sowie Kosten für Chemikalien und Apparaturen. An all dies zu denken, dafür müssen Studierende sensibilisiert werden. Im Folgenden tun wir dies anhand einiger Beispiele.
Definitionen
Die Ausbeute [2] ist das Verhältnis der Stoffmenge des tatsächlich erhaltenen Zielproduktes zur theoretisch möglichen Stoffmenge dieses Stoffes und wird in der Regel in Prozent angegeben (Gleichung 1)
![]()
![]()
![]()
Ausbeute
Beginnen wir mit einem Präparat aus unserem Einführungspraktikum. Die Aufgabenstellung lautet:
"Lösen Sie bitte 5,00 g 98%iges Kupfersulfat-Pentahydrat in 50 ml Wasser, rühren eine überschüssige Menge Ammoniak-Lösung hinzu und fällen den gebildeten tiefblauen Komplex durch Zugabe von 200 ml Ethanol aus. Das entstandene Tetraamminkupfer(II)-sulfat-Monohydrat saugen Sie bitte über einen Büchnertrichter mit eingelegtem und angefeuchtetem Filterpapier ab, waschen es dreimal mit jeweils 10 ml Ethanol, trocknen es, indem Sie es im Büchnertrichter belassen und Luft durchsaugen, wiegen es und berechnen die Ausbeute."
Hier die Ausbeuten von drei Studierenden:
- Person A: 102 %
- Person B: 130 %
- Person C: 60 %
Basis der Ausbeute-Berechnung ist die Reaktionsgleichung:
Da das Ausgangsmaterial nach Angabe des Herstellers nur einen Massenanteil von: w(Kupfersulfat-Pentahydrat) = 98 % besitzt, beträgt die Einwaage an reinem Edukt: m(CuSO4 · 5H2O) = 0,98 · 5,00 g = 4,90 g. Mit seiner Molmasse M(CuSO4 · 5H2O) = 249,69 g/mol berechnet sich die Stoffmenge an Edukt zu:
![]()
![]()
- Person A hat fast optimal gearbeitet. Das Filtrat war farblos, was für eine (nahezu) quantitative Umsetzung des Edukts zum Produkt spricht, denn dessen tiefblaue Farbe ist so intensiv, dass sie auch noch im Spurenbereich zu erkennen wäre. Das Produkt enthält aber offensichtlich noch etwas (2 %) Ethanol, das nicht vollständig verdampft ist. Das Produkt dürfte also noch nicht verkauft werden, denn dafür müsste es ganz frei von synthesebedingten Hilfsstoffen sein. Nach einer weiteren Trocknungszeit und einer Elementaranalyse mit den praktikumsüblichen Methoden auf Kupfer (elektrogravimetrisch), Ammoniak (nach Kjeldahl) und Sulfat (gravimetrisch) könnte es dann vermutlich für den Verkauf freigegeben werden.
- Person B hatte es offensichtlich zu eilig. Auch ihr Filtrat war farblos; aber sie hat die erforderliche Trocknungszeit des Präparates deutlich unterschätzt. Es erhielt noch viel (30 %) Ethanol und roch auch danach.
- Person C hatte in der Versuchsvorschrift überlesen, dass das Filterpapier vor der Filtration angefeuchtet werden muss, damit es dicht auf dem Büchnertrichter "klebt". Das trockene Filterpapier wurde hingegen von der zu filtrierenden Suspension unterspült, sodass sich ein Teil des Produktes im Filtrat befand, was deutlich zu sehen war. Damit der/die Studierende nicht am persönlichen Missgeschick bei Experimentieren verzweifelt, sprechen wir von einem "verfahrensbedingten Ausbeuteverlust".
Neben der Giftigkeit von Kupferverbindungen die Luftbelastungen, die beim Verdampfen von Ammoniak und Ethanol entstehen und die durch den Laborabzug zwar von den Experimentatoren ferngehalten werden, aber dennoch in die Außenluft, also in die Natur, gelangen, gibt es das Filtrat, das eine ammoniakhaltige Wasser/Ethanol-Lösung ist, die mit Schwefelsäure neutralisiert und dann der professionellen Chemikalienentsorgung zugeführt werden muss. Trotz seines quantitativen Reaktionsablaufs hat der Versuch einen erheblichen ökologischen Fußabdruck. Abhilfe kann hier am besten eine Reduzierung der Ansatzgröße schaffen. Ausgehend von nur 1,00 g Kupfersulfat-Pentahydrat sollten sich die beschriebenen Phänomene auch beobachten lassen. Aber der größere Ansatz ist natürlich ästhetisch schöner.
Im Organik-Praktikum wird u.a. "Aspirin" hergestellt. Dazu wird Salicylsäure mit überschüssigem Essigsäureanhydrid umgesetzt. Das Zielprodukt Acetylsalicylsäure wird aus Wasser umkristallisiert.
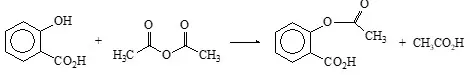
Abb.1: Synthese von "Aspirin"
Der Student ging davon aus, dass (wie bei dem oben geschilderten Kupfer-Präparat) die Umsetzung quantitativ erfolgt. Diese Annahme ist aber falsch, denn, wie eine dünnschichtchromatographische Untersuchung des Rohproduktes beweist, enthält dieses etwas nicht umgesetzte Salicylsäure. Die Berechnung der theoretischen Ausbeute wäre also nur möglich, wenn man die Gleichgewichtskonstante bei der Temperatur der Reaktionsdurchführung kennt.
Um ein sauberes Produkt zu erhalten, musste das Rohprodukt umkristallisiert werden, was automatisch mit einem Ausbeuteverlust und damit auch einem großen ökologischen Fußabdruck verbunden ist. Der Student muss aber keineswegs enttäuscht über seine "geringe" Ausbeute sein, sondern bekommt Respekt davor, welch enormer Optimierungsbedarf besteht, bis eine erste Laborsynthese zu einem ökologisch unbedenklichen wirtschaftlichen Blockbuster führt.
Atomeffizienz
In einem Gedankenexperiment sollen die Studierenden zwei unterschiedliche Verfahren zur "Herstellung von künstlichem Benzin" diskutieren, die auf folgenden Reaktionsgleichungen basieren:
Verfahren B: n CO2 + 3n H2 → [CH2]n + 2n H2O
Die Atomeffizienzen für die beiden Verfahren berechnen sich folgendermaßen:
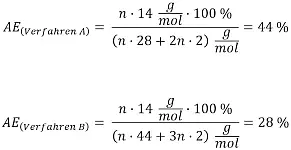
Das Verfahren A ist die klassische Fischer-Tropsch-Synthese, bei der eine CO/H2-Mischung (sog. Synthesegas) eingesetzt wird, die aus der Kohlevergasung (Kohle und Wasser) oder dem Steamreforming (Methan und Wasser), also aus den fossilen Rohstoffen Kohle bzw. Erdgas, stammt. Wenn man das entstandene Benzin nachher verbrennt, entsteht Kohlenstoffdioxid, welches den Treibhauseffekt beschleunigt.
Das Verfahren B beschreibt die Herstellung von E-Kraftstoff (engl.: E-Fuel, electrofuel). Hierbei wird Kohlenstoffdioxid aus Abgasen von Industrieprozessen oder aus der Atmosphäre entnommen und mit "grünem" Wasserstoff zur Reaktion gebracht, der aus der Elektrolyse von Wasser resultiert, die mit Ökostrom betrieben wird. Wenn man den E-Kraftstoff nachher verbrennt, entsteht zwar auch Kohlenstoffdioxid, aber nur so viel, wie der Luft zuvor bereits entzogen worden ist. Die Ökobilanz eines E-Fuels ist also besser als die eines Fischer-Tropsch-Kraftstoffes.
Auch das folgende Beispiel soll verdeutlichen, dass eine höhere Atomökonomie nicht unbedingt gleichzusetzen ist mit einer besseren Ökobilanz. Und zwar sollen die Studierenden zwei verschiedene Verfahren zur "Herstellung von Ethanol" diskutieren. Die Reaktionsgleichungen dazu lauten:
Verfahren B: C6H12O6 → 2 CH3CH2OH + 2 CO2
Die Atomeffizienzen für diese beiden Verfahren berechnen sich folgendermaßen:
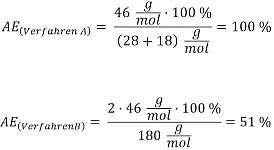
Umweltfaktor
Im Green-Chemistry-Curriculum der Yale-Universität [5] haben wir ein hübsches Experiment gefunden, dass den Begriff Umweltfaktor anschaulich erklärt. Ein Student soll eine große Tüte Smarties nach Farben sortieren und auszählen. Er darf aber nur eine Sorte, z.B. die roten Smarties naschen. Die anderen sind für ihn tabu, und er muss sie entsorgen. Der Anteil der verschieden gefärbten Schokolinsen ist - vom Hersteller so eingestellt - gleich, jeweils 20 % rote, grüne, blaue, gelbe und braune Linsen. Damit berechnet sich der Umweltfaktor für die roten Smarties:
Das ist ein ziemlich hoher Wert; und 80 vom 100 Smarties wegzuschmeißen, um nur die 20 roten zu naschen, tut einem Süßigkeiten-Freak schon weh. Wenn sich nun aber unter den anderen Studierenden selektive Liebhaber für grüne, blaue, gelbe und braune Smarties finden, werden diese auch verputzt, und der gesamte Umweltfaktor berechnet sich zu:
Ein ökologischer und ökonomischer Idealzustand - und alle Studierenden sind glücklich. Als Wermutstropfen muss vermerkt werden, dass die Verpackung der Smarties Abfall ist und der Umweltfaktor des Smarties-Spiel deshalb doch nicht ganz Null ist.
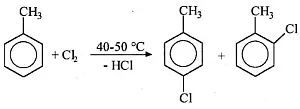
- Abb.2: elektrophile Chlorierung von Toluol
Nun ein analoges Beispiel aus der industriellen Chemie. Bei der klassischen elektrophilen Chlorierung von Toluol fielen para- und ortho-Chlortoluol im Verhältnis 1:1 an.
Das para-Isomer konnte der Hersteller, die Firma Bayer, problemlos verkaufen; für das ortho-Isomer war nicht so ein reger Bedarf, sodass der Produzent auf der Hälfte davon "sitzen blieb", den Stoff also kostspielig und umweltbelastend der chemischen Sondermüllverbrennung übergeben musste. Der Umweltfaktor für die Trennung der beiden Isomeren betrug:
Dies war nicht akzeptabel - genauso wie es nicht hinnehmbar war, die nicht-roten Smarties wegzuwerfen -, sodass, der Prozess optimiert wurde. Die Lösung brachte ein neuer Katalysator [6]. Es wurde geheim gehalten, um welchen es sich handelte; vielleicht ein sperriges Aluminiumorganyl, welches das angreifende Chlor etwas mehr in die sterisch weniger behinderte para-Position drängte, sodass ein Isomerenverhältnis resultierte, das genau den Mengenanforderungen des Marktes entsprach. Damit ergab sich für das neue Verfahren ein idealer Umweltfaktor:
Ein lehrreiches Beispiel dafür, dass Umweltschutz nicht immer nur mit Kosten verbunden ist, sondern dass eine in jeder Hinsicht optimierte Synthese auch am besten für die Umwelt und den Profit des Unternehmens ist. Ergänzend muss - wie bei dem Smarties-Experiment - noch auf die als Nebenprodukt anfallende Salzsäure eingegangen werden. Da sie aber durch Destillation in eine hochreine Form gebracht und verkauft werden kann, verschlechtert ihr Anfallen die Gesamtbilanz des Verfahrens allerdings kaum.
Zum Schluss möchten wir den Umweltfaktor in Zusammenhang mit der Gewinnung eines wichtigen Übergangsmetalls reflektieren, und zwar des Cobalts, welches vor allem für das Kathodenmaterial in Lithium-Cobaltoxid-Akkumulatoren benötigt wird. Die reichhaltigsten Erze gibt es in der Demokratischen Republik Kongo. Im Durchschnitt weisen sie einen Massenanteil w(Co) = 4,2 % auf [7]. Nehmen wir zunächst an, man könnte das Metall einfach so aus dem Erz herausziehen, dann würde sich der Umweltfaktor berechnen zu:
Eine riesige Menge Gangart müsste auf die Deponie gelegt werden. Das allein wäre schon eine energetisch gigantische Anstrengung. Entlastend ist, dass die Cobalterze im Durchschnitt auch noch 13,6 % Kupfer enthalten [7], dessen parallele Gewinnung die Wertschöpfung erhöht. Belastend und den Umweltfaktor deutlich verschlechternd wirken sich hingegen die erforderlichen chemischen Aufbereitungsverfahren aus, die mit vielen und zum Teil giftigen Chemikalienabfällen verbunden sind, bis man schließlich ein reines Cobalt(II)-sulfat hat.
Zudem ist die politische Situation in der Republik Kongo zu berücksichtigen. Machtkämpfe und Korruption machten das Cobalt aus diesem Land zu einem Konfliktrohstoff. Und da oft Kinder in mühseliger und gefährlicher Arbeit die Mineralien aus den engen Minen hervorholen, verbieten die Menschenrechte (ethisch) und das neue Lieferkettengesetz (juristisch) den Bezug von Cobalt aus dieser Weltregion - eigentlich. Man erwägt, auf Manganknollen [8] aus der Tiefsee, die auch Cobalt enthalten, auszuweichen. Doch zerstört man durch einen Tiefseebergbau nicht bislang weitgehend unerforschte Ökosysteme [9]?
Fazit
Chemisches Rechnen, meistens auf Basis analytischer Daten, muss man beherrschen, keine Frage. Trotzdem wird es im Anfangsstadium eines Chemiestudiums eher als unliebsame Pflichtaufgabe verstanden. Wenn Chemisches Rechnen aber - wie hier gezeigt - in einen Zusammenhang mit Fragen zur Ökobilanz und Nachhaltigkeit von chemischen Prozessen gestellt wird, bekommt es einen zusätzlichen und tieferen Sinn. Denn, wie eingangs bereits gesagt, müssen Studierende von Anfang an verinnerlichen, dass chemische Synthesen so "grün wie möglich" konzipiert und durchgeführt werden müssen. Das sind wir unserer Zukunft schuldig.
Literatur
- M. Ben Hamouda, S. A. Motamedian, V. Wiskamp: 25 Jahre "Green Chemistry" - Würdigung des wegweisenden Lehrbuches von Paul T. Anastas und John C. Warner. - Chemie in Labor und Biotechnik (CLB) 74 (2023), Heft 7-8, im Druck
- Wikipedia; Ausbeute (Chemie)
- Wikipedia; Atomökonomie
- Wikipedia; E-Faktor
- Beyond Benign: Green Chemistry University Curriculum
- U. Förstner: Umweltschutztechnik - eine Einführung. - 2. Aufl., Springer-Verlag, Berlin Heidelberg 1991, Kap. 1.5.3, S. 41
- Bundesanstalt für Geowissenschaften und Rohstoffe: Analyse des artisanalen Kupfer-Kobalt-Sektors in den Provinzen Haut-Katanga und Lualaba in der Demokratischen Republik Kongo. - Hannover 2019, S. 25;
- Wikipedia; Manganknolle
- J. Reimer: Was mit dem Hochseeabkommen beschlossen wurde. - Deutschlandfunk, 5.4.2023;
