03.08.2023
![]()
Ökologische Kipppunkte - einfache analytische Bestimmungen als Modellexperimente
Mojgan Czernik, Prof. Volker Wiskamp , Hochschule Darmstadt
Wolfgang Proske, Schulchemiezentrum
Aufgrund der Erderwärmung können Kipppunkte erreicht werden, nach deren Überschreitung sich Ökosysteme in kurzer Zeit dramatisch verändern. Im Folgenden werden Schüler und Studienanfänger für diese Thematik anhand einfacher analytischer Bestimmungen sensibilisiert. Erstens werden Phasenübergänge thematisiert, bei denen nach einer Temperaturänderung von weniger als einem Grad Stoffe mit völlig anderen Eigenschaften vorliegen. Zweitens werden Säure/Base- und Redoxtitrationen geschildert, bei denen mit einem Tropfen Maßlösung ein saures in ein alkalisches bzw. ein reduzierendes in ein oxidierendes System "umkippt".
Kipppunkte in der Ökologie
Werden Kipppunkte - das ist ein Begriff aus der Erdsystemforschung [1] - überschritten, können sich Ökosysteme sehr schnell in einem großen Maße und vermutlich irreversibel ändern. Bei einer Erwärmung der Erdatmosphäre um mehr als 1,5 °C gegenüber der vorindustriellen Zeit nimmt die Wahrscheinlichkeit, dass Kipppunkte erreicht werden, deutlich zu. Drei typische Beispiele:
- Eisschmelze. Wenn Festland- und Meereseis schmelzen, steigt der Meeresspiegel, was zu Überflutungen von flachen Küstenregionen führen kann, und der Salzgehalt des Meerwassers nimmt ab (Eis ist Süßwasser), woran sich Meereslebewesen nur langsam anpassen können und eventuell aussterben.
- Erliegen des Golfstroms. Wenn mehr warmes Oberflächenwasser vom Äquator nach Norden strömt und gleichzeitig Süßwasser aus geschmolzenem Eis die Dichte des Polarwassers verringert, werden die bisherigen Wasserströmungen gestört und der Golfstrom, der äquatoriale Wärme in unsere Breiten transportiert, kann stoppen, was eine neue Kaltzeit zur Folge hätte.
- Auftauen des Permafrost-Bodens. Im Permafrost sind große Mengen Methan gebunden. Taut der Boden auf, entweicht dieses in die Atmosphäre und heizt sie weiter auf, denn Methan ist ein fast dreißigmal effektiveres Treibhausgas als Kohlenstoffdioxid.
Kipppunkte im Chemieunterricht
Im Chemieunterricht sollte jede Möglichkeit genutzt werden, um den Klimawandel und seine ökologischen Folgen zu thematisieren. "Kipppunkte" gibt es in der Chemie auch - sie werden nur selten so bezeichnet. Beispielsweise Phasenübergänge, bei denen sich die Eigenschaften eines Stoffes bei einer Temperaturveränderung von weniger als einem Grad drastisch verändern. Oder man denke an eine Titration mit Farbindikation; man gibt viele Tropfen einer Maßlösung zum Analyten und optisch passiert lange Zeit nichts - doch dann, mit einem Tropfen ist ein Farbumschlag da und aus einer sauren Lösung ist eine basische oder aus einer reduzierenden eine oxidierende geworden. Eine ganz kleine Temperaturänderung oder ein Tropfen einer Chemikalie reichen aus, und man hat völlig neue physikalische und/oder chemische Eigenschaften.
Im Folgenden werden einige einfache, bekannte und eindrucksvolle Experimente im ökologischen Kontext der Kipppunkte neu interpretiert.
Phasenübergang fest/flüssig

- Abb.1: Phasenübergang fest/
flüssig, links von Kerzenwachs,
rechts von Eis [2].
Ein zunächst langweiliges Experiment. Mehrere Minuten passiert gar nichts. Doch dann, in wenigen Sekunden, ist der weiße Feststoff zu einer farblosen Flüssigkeit geworden. An seinem Schmelzpunkt "kippt" der kristalline Stoff, bei dem alle Moleküle auf definierten Gitterplätzen mit Nah- und Fernordnung sitzen, in seine flüssige Form "um", in der sich die Moleküle bewegen und den Raum einnehmen, der ihnen zur Verfügung steht, d.h. sie fließen.
Man kann das Experiment auch anders herum durchführen und die Probe in eine auf ca. 150 °C vorgewärmte Apparatur geben. Sofort resultiert eine Schmelze. Wenn man die Apparatur abkühlen lässt, ist der Versuch zunächst wieder recht langweilig. Doch sobald der Errstarrungspunkt erreicht ist, wird die anfangs klare Schmelze schlagartig fest.
Lassen wir die Schüler bzw. Studierenden den Phasenübergang fest/flüssig in modifizierter Form durchführen: In einem großen Reagenzglas wird Kerzenwachs, in einem zweiten Glas Eis erhitzt. Die Praktikanten erkennen, wie die ersten Wachs- bzw. Eisstückchen schmelzen und Zweiphasensysteme entstehen (Abbildung 1). Im System festes/flüssiges Wachs liegt der Feststoff auf dem Gefäßboden, weil er eine höhere Dichte hat als im flüssigen Aggregatzustand. Im System Eis/Wasser ist es umgekehrt; der Feststoff hat die geringer Dichte als seine flüssige Phase und schwimmt darauf. Das fest/flüssig-System Eis/Wasser verhält sich im Vergleich zu den meisten anderen Stoffen so, weshalb man von Anomalie spricht.

- Abb.2: "Sprengwirkung" von
gefrierendem Wasser. Links ein mit
Wasser gefülltes Filmdöschen, rechts
eine mit Wasser gefüllte Glasflasche
nach Lagerung im Tiefkühlschrank [2].
Folgender Ergänzungsversuch ist lehrreich. Ein Filmdöschen und eine Glasflasche werden randvoll mit Wasser gefüllt, fest verschlossen und in den Gefrierschrank gestellt. (Sicherheitshinweis: Die wassergefüllte Glasflasche wird zuvor noch in eine Plastiktüte gepackt.) Das entstehende Eis hat wegen seiner geringeren Dichte einen größeren Platzbedarf und sprengt deshalb das jeweilige Gefäß (Abbildung 2) - eine enorme Kraft, die nach Überschreiten eines Kipppunktes aufgebaut wird.
Phasenübergang flüssig/gasförmig

- Abb.3: Wasserkochen - ein Grund-
schüler studiert den Phasen-
übergang flüssig/gasförmig [2].
Genauso spannend ist - schon für Grundschulkinder - das Wasserkochen, also der Übergang von flüssigem Wasser in die Gasphase (Abbildung 3). Aufgeregt verfolgen die Jungforscher das Klettern der Säule im Thermometer, wenn das Wasser immer wärmer wird. Überrascht sind sie, dass die Temperatur dann bei 100 °C plötzlich stehenbleibt. Ein Kipppunkt ist erreicht: Das Wasser sprudelt kräftig und Dampf entweicht aus dem Erlenmeyerkolben. Jetzt ist das System zweiphasig, und die weiterhin mit dem Brenner zugeführte Wärmeenergie wird zum Brechen der Wasserstoffbrückenbildungen im flüssigen Wasser benötigt, damit einzelne Wassermoleküle in die Gasphase treten können, wo sie - nach der Definition des idealen Gaszustandes - nicht mehr wechselwirken.
Zwei Säure-Base-Titrationen
Zu einer Salzsäure mit etwas Phenolphthalein wird aus einer Bürette Natronlauge-Maßlösung getropft. Ein zunächst recht langweiliges Experiment, weil scheinbar nichts passiert. Doch dann, mit einem weiteren Tropfen Maßlösung, färbt sich die Lösung im Erlenmeyerkolben plötzlich rot. Ein Kipppunkt wurde überschritten. Bis dahin war das Medium im Kolben sauer. Ganz am Anfang lag Salzsäure in Wasser vor; mit zugesetzter Natronlauge bildetet sich Natriumchlorid - es war aber immer noch überschüssige Säure vorhanden. Erst als diese auch neutralisiert war, bewirkte der nächste Tropfen Maßlösung, dass die Lösung im Erlenmeyerkolben alkalisch wurde.
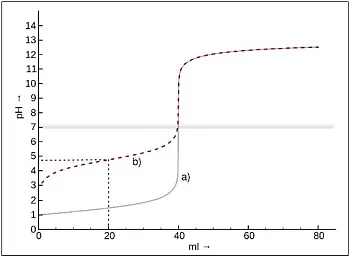
- Abb.4: Berechnete Titrationskurven von Salzsäure (a)
und Essigsäure (b) gegen Natronlauge [3].
Auch bei der Titration von Essigsäure mit Natronlauge beobachten die Schüler bzw. Studierenden den plötzlichen Farbumschlag von Phenolphthalein von farblos nach rot.
Dieses Experiment eignet sich, um ergänzend und exemplarisch ein Puffersystem zu thematisieren. Wenn ein Teil der schwachen Essigsäure mit der starken Natronlauge reagiert hat, liegen überschüssige Essigsäure und ihr Salz, das Natriumacetat, nebeneinander vor. Der pH-Wert dieser Mischung berechnet sich nach der Hasselbalch-Henderson-Gleichung:
![]()
Kurz erwähnt sei hier noch, dass die Natur voller Puffer ist. Im Meer und im Blut haben wir Puffersysteme aus Kohlensäure, Hydrogencarbonat und Carbonat, die den pH-Wert weitgehend konstant halten, aber bei zu viel Eintrag von Kohlenstoffdioxid ins Saure umkippen können. In Lebewesen sind es weiterhin vor allem Aminosäuren und Proteine, welche die Puffersysteme Carbonsäure/Carboxylat und Ammonium/Amin gleichzeitig enthalten und eine weitgehende pH-Konstanz, die bei Lebensprozessen wichtig ist, garantieren.
Eine Redoxtitration
Auch bei Redoxtitrationen gibt es Kipppunkte. Z.B. bei der iodometrischen Bestimmung von Ascorbinsäure. Die Experimentatoren legen die zu bestimmende Vitamin-Lösung im Erlenmeyerkolben vor, geben etwas frisch bereitetet Stärke-Lösung als Indikator zu und dann tropfenweise Iod-Maßlösung aus der Bürette. Lange Zeit passiert sichtbar nichts, dann färbt sich die Lösung im Kolben aber schlagartig tiefblau. In dem Moment ist die reduzierend wirkende Ascorbinsäure (in der Pharmazie spricht man von einem vor unerwünschten Oxidationen schützenden Antioxidans) verbraucht und etwas von dem Oxidationsmittel Iod liegt im Überschuss vor, das mit dem Kohlenhydrat einen blauen Einlagerungskomplex bildet. Wieder ein Systemwechsel, jetzt von reduzierend zu oxidierend, mit einem Tropfen und im Bruchteil einer Sekunde.
Fazit
Wir haben immer wieder erlebt, dass Schüler und Studierende besonders beeindruckt sind, wenn wir über die reine physikalische Chemie der Phasenübergänge und die maßanalytischen Bestimmungsmethoden hinaus den Bezug zur Ökologie herstellen. Der Chemieunterricht vermittelt dann: Vor Kipppunkten muss man größten Respekt haben! Und das Sprichwort von Tropfen, der das Fass zum Überlaufen bringt, wird auf eine neue Art und Weise verständlich.
Literatur
- Wikipedia: Kippelemente im Erdklimasystem
- V. Wiskamp: Naturwissenschaftliches Experimentieren - nicht erst ab Klasse 7. - 3. Aufl. (inkl. CD-ROM), Shaker Verlag, Aachen 2008
- Roland.chem: Berechnete Titrationskurven von Salzsäure und Essigsäure gegen Natronlauge. - Wikimedia (gemeinfrei), 6.3.2009;
Mojgan Czernik studiert Chemische Technologie an der Hochschule Darmstadt. Teile der vorliegenden Publikation stammen aus ihrer Bachelorarbeit.
