16.11.2023
WASoMI on Tour - Mit Schülern und Lehrkräften dem Mikroplastik auf der Spur
Dr. Katrin Schuhen , Dr. Michael Sturm, Wasser 3.0
Unter dem Namen WASoMI werden die Bildungs- und Tätigkeitsfelder der gemeinnützigen GmbH (gGmbH) Wasser 3.0 mit verschiedenen Projekten und Angeboten rund um Wasser ohne Mikroplastik gebündelt. Die zentrale Fragestellung innerhalb des Bildungsangebots lautet: Wie werden Kunststoffe - unsere Alltagshelfer - zum Umweltproblem und was können wir dagegen tun?
Neben einer digitalen Wissensplattform startete im Juni und Juli 2023 für mehr als 5.000 Schülerinnen und Schüler im Teil-Projekt Freiräume eine ganz besondere Mikroplastik-Spurensuche. An 101 Wassertagen entstanden neue Lehr-/Lernumgebungen für Schüler und Lehrkräfte an, im und rund ums Wasser. 57 Proben von 54 Standorten schafften den Weg ins Labor. Hierzu gehören große Gewässer, wie der Rhein, Donau, der Bodensee oder die Ostsee, aber auch kleine Gewässer wie der Metisweiler Weiher oder der Wildenauer Badesee. Die Ergebnisse der Analytik werden in diesem Beitrag zusammengefasst.
Von der Probennahme bis zum Ergebnis
Bei der Probennahme ist es essenziell, die Kontamination der Proben mit weiteren Mikroplastik-Partikeln zu vermeiden. Daher werden nur Glasgeräte für die experimentelle Arbeit verwendet und alle Glasgeräte werden für die Schülerversuche bereitgestellt, um einen größtmöglichen Probennahme-Standard zu erreichen.

Abb.1: Links: Schülerin bei der Probennahme zur Mikroplastik-Detektion.
Rechts: Fotos der Wasser 3.0 Forschungsstation (© Pure Water for Generations e.V. und Wasser 3.0 gGmbH)
Probenaufarbeitung und Mikroplastik-Detektion
Im Analytik-Labor werden die Proben zunächst für die Mikroplastik-Detektion, basierend auf Fluoreszenz-Mikroskopie, vorbereitet (Abbildung 2). Um die Messung effizienter und weniger fehleranfällig zu machen, wird im ersten Schritt die Anzahl der natürlichen Partikel, welche die Anzahl der Mikroplastik-Partikel bei weitem übersteigen, reduziert [1, 2].

Abb.2: Vorgehen zur Aufarbeitung der Proben zur Mikroplastik-Detektion im Analytik-Labor von Wasser 3.0 (© Wasser 3.0 gGmbH)
Um die Proben für die Fluoreszenzmikroskopie und finale Detektion vorzubereiten, werden sie im nächsten Schritt mit einem Mix verschiedener Fluoreszenzmarker angefärbt und auf einen schwarzen, nicht fluoreszierenden Filter gefiltert. Diese Fluoreszenzmarker-Komposition ist das Ergebnis langjähriger Forschung von Wasser 3.0 in Kooperation mit der abcr GmbH und wurde speziell designt um selektiv Mikroplastik, jedoch nicht natürliche Partikel anzufärben [1-3].
Hierzu wird die 100 ml Probe mit 0.25 mg/l Fluoreszenz-Marker (abcr eco Wasser 3.0 detect mix MP-1, abcr GmbH, Karlsruhe, Deutschland) für 1 Stunde bei 80 °C angefärbt. Nach dem Anfärben wird die Proben über eine schwarze Filtermembran gefiltert. Anschließend werden Fluoreszenz-Aufnahmen angefertigt. Hierbei lässt sich Mikroplastik anhand des hellen Fluoreszenzsignals identifizieren und detektieren.
Detektion
Betrachtet man die angefärbte Probe unter dem Fluoreszenzmikroskop, leuchtet das Mikroplastik hell, natürliche Partikel jedoch nicht oder nur sehr schwach (Abbildung 3). Durch den Einsatz der Fluoreszenzmarkierung können Mikroplastik-Partikel von natürlichen Partikeln unterschieden sowie kostengünstig und schnell detektiert werden.
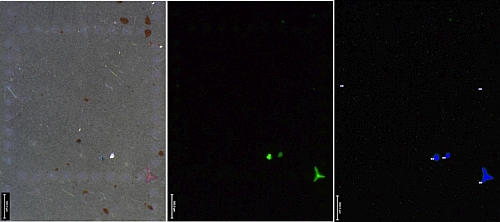
Abb. 3: Foto, Fluoreszenzaufnahme und automatisiert detektiertes Mikroplastik der Probe vom Traunsee (Nr. 9, Abbildung 4).
Zur Fluoreszenzanregung wurden LED-Taschenlampen verwendet. Um das von den Taschenlampen reflektierte Licht zu blockieren und nur das aus der Fluoreszenz resultierende Licht zum Mikroskop durchzulassen, wurden optische Filter mithilfe einer speziell angefertigten Halterung (Bartmann Maschinenbau GmbH, Rülzheim, Deutschland) vor das Mikroskop-Objektiv montiert.
Zur Auswertung der Proben wird die automatische Partikeldetektion der Mikroskop-Software verwendet (Abbildung 3). Über einen Helligkeitsgrenzwert wird zwischen Mikroplastik und natürlichen Partikeln unterschieden, welcher zuvor an Standards, bestehend aus natürlichen Partikeln und Mikroplastik, definiert wird [1, 2].
Ergebnisse und Diskussion
Die gemessenen Mikroplastik (MP)-Konzentrationen liegen zwischen 0 und 247 MP/l, mit einem Mittelwert von 24.7 ± 38.5 MP/l und einem Median von 14 MP/l. Von den 54 untersuchten Standorten wurde an sieben keine Mikroplastik-Belastung festgestellt. 17 Proben wiesen eine Mikroplastik-Belastung von 2 bis 10 MP/L auf. Mit über 10 MP/l waren 31 Gewässerproben hochbelastet, mit 247 MP/l zeigt die Probe vom Roggenburger Weiher die mit Abstand stärkste Kontamination.
Da es sich hierbei um Stichproben aus einem Schülerversuch handelt, kann ein Eintrag von Mikroplastik in die Proben nicht ausgeschlossen werden. Zudem handelt es sich aufgrund der geringen Probenmenge um nicht repräsentative Stichproben, die nur einer Abschätzung der Mikroplastik-Belastung dienen. Zu beachten ist ebenfalls, dass nur weil man keine Mikroplastik-Belastung in der Stichprobe gefunden hat, dies nicht bedeutet, dass kein Mikroplastik im Gewässer vorhanden ist. Mikroplastik verteilt sich heterogen in der Umwelt, sodass es bei Stichproben zu hohen wie auch sehr niedrigen Messwerten kommen kann.
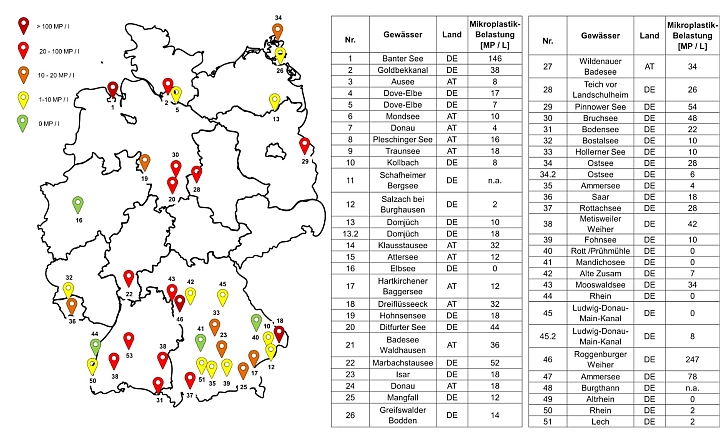
Abb.4: Visualisierung der Messergebnisse in Mikroplastik pro Liter (MP/l) der Gewässer in Deutschland. Über die Nummerierung sind die Messpunkte der Tabelle zugeordnet.
Hinweis in eigener Sache
Mehr zu den Forschungs- und Bildungsprojekten erfahren Sie über unsere Webseite. Unseren kostenfreien virtuellen Bildungsraum mit vielen Mikrolerneinheiten, Videos und Verweisen können Sie über WASoMI erreichen.
Danksagung
Vielen Dank an die Teilnehmenden der Deutschen Postcode Lotterie für die Teilfinanzierung des Projekts Freiräume. Vielen Dank an Pure Water for Generations e.V. für die Kooperation bei der Durchführung der Wassertage. Vielen Dank an die abcr GmbH aus Karlsruhe für die Sachspenden. Vielen Dank an die Spender:innen und Sponsor:innen, die durch ihre Mithilfe ermöglichten, dass wir das Projekt in diesem Umfang umsetzen konnten.
Quellenangaben
- Sturm MT, Myers E, Korzin A, Polierer S, Schober D, Schuhen K. Fast forward: Optimized sample preparation and fluorescent staining for microplastic detection, Microplastics, submitted for minor revision 28 Jul 2023.
- Sturm MT, Myers E, Schober D, Korzin A, Schuhen K. Development of an Inexpensive and Comparable Microplastic Detection Method Using Fluorescent Staining with Novel Nile Red Derivatives. Analytica. 2023;4:27-44.
- Sturm MT, Horn H, Schuhen K. The potential of fluorescent dyes-comparative study of Nile red and three derivatives for the detection of microplastics. Anal Bioanal Chem. 2021;413:1059-71.
