15.04.2021
Anwendung neuer Fluoreszenzmarker macht die Detektion von Mikroplastik in Umweltproben einfach, schnell und kostengünstig
Dr. Katrin Schuhen , Michael Sturm, Wasser 3.0
Wir wissen, dass Mikroplastik ein globales Umweltproblem mit hohem Risikopotential für Mensch und Ökosysteme ist. Es bestehen jedoch noch weitreichende Wissenslücken, die es zu schließen gilt, um wirksam gegen die weitere Verteilung vorzugehen [1].
Die Detektion von Mikroplastik spielt dabei eine entscheidende, lang vernachlässigte, Rolle. Herkömmliche Verfahren liefern zu wenige und unzuverlässige Informationen über Vorkommen, Eintrag und Gefahren von Mikroplastik.
Es bedarf einer einfachen, schnellen und kostengünstigen Mikroplastikanalytik [2]. Fluoreszenzmarker weisen hierfür große Potentiale auf, da diese Mikroplastik selektiv anfärben und somit in Umweltproben einfach sichtbar machen (Abbildung 1) [3].
Das Projekt Wasser 3.0 detect nutzt dieses Potential und entwickelt neue Marker, die es ermöglichen, Mikroplastik weniger fehleranfällig und ohne komplizierte Probenaufarbeitung anzufärben. Zur automatisierten Messung und Auszählung der Probe stehen zahlreiche technische Möglichkeiten zur Verfügung. Fluoreszenzmarker haben somit ein hohes Potential neue Standards in der Mikroplastikanalytik zu setzen.
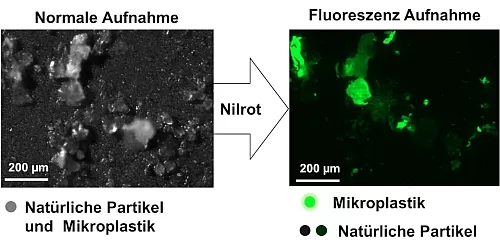
Abb.1: Vergleich einer Normalen- und einer Fluoreszenzaufnahme einer mit Nilrot
gefärbten Umweltprobe, aufgearbeitet zur Mikroplastikdetektion [3].
Wozu brauchen wir Mikroplastikanalytik?
Inzwischen ist es weithin bekannt, dass Mikroplastik ein globales Umweltproblem darstellt [1]. Plastikmüll, der durch unsachgemäße Entsorgung in der Umwelt landet, wird nicht einfach abgebaut und verschwindet. Er wird mit der Zeit spröde und zerfällt in immer kleinere Plastikpartikel. Ab einer Größe unter 5 mm spricht man von Mikroplastik. Auch auf direktem Weg, z.B. als Reifenabrieb oder synthetische Fasern aus Textilien, kann Mikroplastik in die Umwelt gelangen. Mikroplastik sammelt sich seit dem Beginn der industriellen Massenproduktion in den 1950er Jahren in der Umwelt an. Es ist inzwischen überall zu finden: Im Meer, in Seen und Flüssen, in Böden, in der Luft, sogar in menschlicher Nahrung [4].
Da die Mikroplastik Analytik sehr kompliziert und aufwändig ist, gibt es noch große Wissenslücken [1,2]. Wie ist die reale Kontamination an unterschiedlichen Orten und zu unterschiedlichen Zeiten? Wie ist das Verhalten von Mikroplastik als Transportvektor von anderen chemischen (Weichmacher, PFAS, Pestizide) und in der Umwelt vorhandenen Stoffen? Um das Gefahrenpotential für Ökosysteme und Organismen in der Umwelt, aber auch für Menschen, welche das Mikroplastik über Nahrung, Trinkwasser und Luft aufnehmen, abschätzen zu können, bedarf es daher einer einfachen und günstigen Methode um Mikroplastik nachweisen zu können. Nur wenn man weiß, wo wieviel Mikroplastik ist, wie es transportiert wird und wo es sich ansammelt, kann man die Gefahren realistisch einschätzen. Auch ist es ein hilfreiches Mittel, um Stoffströme zu verfolgen, wodurch man Mikroplastikquellen identifizieren und gegen diese vorgehen kann.
Herkömmliche Methoden machen die Detektion von Mikroplastik fehleranfällig, schwierig und teuer
Mikroplastik in der Umwelt nachzuweisen ist eine große Herausforderung. Plastik besteht aus synthetischen organischen Polymeren. Organismen, also Pflanzen und Tiere, sind hauptsächlich aus natürlichen organischen Polymeren aufgebaut. Sowohl Plastik als auch Tier- und Pflanzenrückstände weisen somit chemisch sehr ähnliche - wenngleich hochkomplexe und vielfältige - Strukturen und Zusammensetzungen auf. Die Unterscheidung von Mikroplastik und natürlichen Partikeln, die in Umweltproben die Anzahl an Mikroplastik um ein Vielfaches übersteigen, ist aufgrund der zahlreichen Erscheinungsformen und Eigenschaften bei chemisch ähnlicher Zusammensetzung äußerst anspruchsvoll und schwierig durchzuführen [2,5].
Eine rein optische Unterscheidung unter dem Mikroskop ist sehr fehleranfällig, da Mikroplastik und natürliche Partikel leicht verwechselt werden können. Somit sind hier nur Schätzungen möglich. Um Mikroplastik sicher zu identifizieren braucht es eine exakte und tiefgehende chemische Analyse der Zusammensetzung der einzelnen Partikel. Hierfür kommen derzeit hauptsächlich Raman-Mikroskopie oder Fourier-Transform-Infrarot-Mikroskopie zum Einsatz. Dabei tastet ein Laser, welcher die genaue chemische Zusammensetzung messen kann, die gesamte Probe ab und kann so Mikroplastik sicher chemisch identifizieren.
Auch wenn sich dies einfach anhört, ist es ein zeitaufwendiger und technisch hochanspruchsvoller Prozess, für den es sowohl teure Messgeräte als auch geschultes Personal zum Bedienen Geräte und Auswerten der Ergebnisse braucht. Zusätzlich dauert die Messung einer Probe, je nach gewählten Parametern, wie minimale detektierbare Partikelgröße, zwischen 2-72 Stunden pro Probe. Das macht den Prozess unpraktisch, teuer und ermöglicht nur einen geringen Probendurchsatz.
Fluoreszenzmarker zur Detektion von Mikroplastik als einfache, schnelle und günstige Alternative
Bei der Suche nach einer schnellen, kostengünstigen Alternative zur selektiven Detektion von Mikroplastik stießen Forschende auf den Fluoreszenzfarbstoff Nilrot [3,6]. Hierbei konnte gezeigt werden, dass Mikroplastikpartikel, welche mit Nilrot angefärbt wurden, deutlich heller leuchten als natürliche Partikel (Abbildung 1). Gibt man also Nilrot zu einer für die Mikroplastikanalytik aufgearbeiteten Umweltprobe, kann man anschließend unter einem Fluoreszenzmikroskop einfach das hell leuchtende Mikroplastik von den nicht oder deutlich dunkler leuchtenden natürlichen Partikeln unterscheiden. Dies erleichtert und beschleunigt den Detektionsprozess ungemein. Jedoch hat der Prozess noch gewisse Nachteile und Optimierungsbedarf.
So können sehr polare Polymere, wie beispielsweise PVC, mit dieser Methode nur schwer detektiert werden (Abbildung 2). Aufgrund ihrer Interaktion mit Nilrot zeigen sie nur ein sehr schwaches Fluoreszenzsignal. Des Weiteren können farbige Plastikpartikel, besonders schwarze Partikel, die Fluoreszenz von Nilrot abschwächen. Somit kann es zu einer Unterschätzung von Mikroplastik in der Probe kommen.
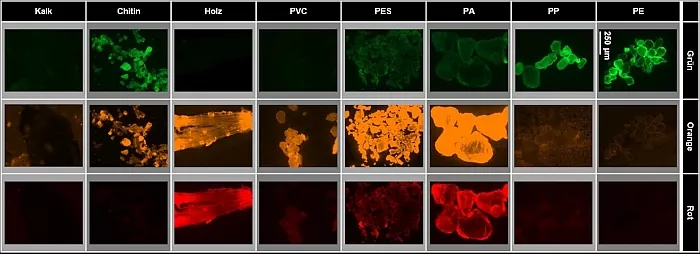
Abb.2: Verschiedene Polymere und natürliche Partikel gefärbt mit Nilrot in Kombination mit einem neu entwickelten
Derivat. Es ist zu sehen, dass verschiedene Fluoreszenzfarben unterschiedliche Intensitäten bei der verschiedenen
Partikel erzeugen. Für die Unterscheidung von natürlichen Partikeln und Mikroplastik ist grün am besten geeignet [3].
Ein weiteres Problem ist, dass manche natürlichen Polymere stark mit Nilrot interagieren und dadurch eine ähnlich helle Fluoreszenz wie Plastik haben [3,7]. Sie werden fälschlicherweise als Mikroplastik identifiziert. Ein Beispiel hierfür ist Chitin, ein Biopolymer aus welchen das Exoskelett von Gliederfüßer wie Insekten und Spinnen sowie von Krustentieren besteht (Abbildung 2). Mit einer entsprechenden Probenaufarbeitung kann man jedoch das Fluoreszenzsignal abschwächen und eine falsche Identifizierung als Mikroplastik verhindern (Abbildung 3). Eine Möglichkeit hierzu ist, die Probe in Wasserstoffperoxid zu kochen, was das Chitin stark angreift, jedoch nicht das Mikroplastik. Eine schonendere Alternative ist die Behandlung mit Enzymen, welche spezifisch für den Abbau von Biopolymeren geeignet sind. Dies macht den gesamten Detektionsprozess jedoch und arbeits- und zeitintensiv.
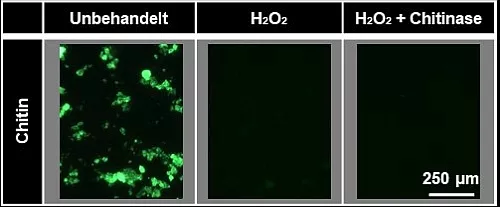
Abb.3: Fluoreszenzaufnahmen von Chitin gefärbt mit Nilrot nach einer
Wasserstoffperoxid bzw. Chitinasebehandlung. Man erkennt eine
sehr starke Abschwächung des Fluoreszenzsignales [3].
Die nächste Generation von Fluoreszenzmarkern: simpel, selektiv, sofort sichtbar.
Aufgrund der erläuterten Problematiken bei der Anwendung von Nilrot besteht dringender und hoher Bedarf an neuen Fluoreszenzmarkern mit diesen Anforderungen [3]: Verbesserte Selektivität gegenüber Mikroplastik und damit Vereinfachung der Probenaufarbeitung sowie verbesserte Detektion von polaren Polymeren. Kurz gesagt - einfach anzuwenden, schnell und kostengünstig. Diesem Ziel hat sich das Projekt Wasser 3.0 detect verschrieben und forscht seit Anfang 2019 an verbesserten Fluoreszenzfarbstoffen.
Automatisierung des Detektionsprozesses
Wurde eine Probe mit Fluoreszenzmarkern angefärbt, kann man diese händisch unter einem Fluoreszenzmikroskop auszählen. Dies ist jedoch zeitintensiv und fehleranfällig, da die inspizierende Person selbst entscheiden muss, ab welcher Helligkeit ein Partikel Mikroplastik ist oder nicht. Ein weitaus schnellerer und zuverlässigerer Ansatz ist der Einsatz von automatisierten Bildgebungswerkzeugen. Diese können einfache Fluoreszenzkameras oder vollautomatisierte Fluoreszenzmikroskope sein, welche von der gesamten Probe Fluoreszenzbilder aufnehmen können. Als besonders kostengünstige Variante besteht die Möglichkeit, herkömmliche Stereolupen oder Mikroskope mittels UV-Lampe als Lichtquelle und Farbfolie als Fluoreszenzfilter in ein Fluoreszenzmikroskop umzuwandeln [8].
Die Fluoreszenzaufnahmen der Proben können mittels Mikroskop- bzw. Kameraeigener Software direkt ausgewertet werden. Alternativ steht die Anwendung von Open Source Bildanalyseprogrammen wie ImageJ zur Verfügung [9]. Zur Bildanalyse wird ein Grenzwert definiert, ab welcher Helligkeit ein Partikel als Mikroplastik gewertet wird. Anschließend wird das komplette Bild analysiert und Partikel, welche diesen Helligkeitswert erreichen oder überschreiten, werden automatisch als Mikroplastik erkannt, ausgezählt und vermessen. Neuste Fluoreszenzmikroskope können in Kombination mit einer komplexeren Bildanalytik, der sogenannten Phasenanalyse, bereits einzelne Plastiksorten unterscheiden, was das Potential dieser Methode unterstreicht [10].
Ausblick
Die hier vorgestellten neuen Ansätze zur schnellen, einfachen und kostengünstigen Mikroplastik-Detektion mit Fluorezenzmarkern aus dem Forschungsumfeld von "Wasser 3.0 detect" könnten in Zukunft als neuer Standard eingesetzt werden. Der große Vorteil wäre, dass mit schnellen Feedbacks zur Mikroplastikbelastung in laufenden Prozessen eine effektive Prozessüberwachung und effiziente Prozessoptimierung möglich wird. Dies wäre ein großer Schritt in Richtung vorsorgenden, aktiven und messbaren Umweltschutz in der (Ab-)Wasserreinigung und ein großer Beitrag zur Erreichung der Nachhaltigkeitsziele der Vereinten Nationen.
Literatur
- N.P. Ivleva, A.C. Wiesheu, R. Niessner, Microplastic in Aquatic Ecosystems, Angewandte Chemie (International ed. in English) (2016).
- T. Rocha-Santos, A.C. Duarte, A critical overview of the analytical approaches to the occurrence, the fate and the behavior of microplastics in the environment, TrAC Trends in Analytical Chemistry 65 (2015) 47-53.
- M.T. Sturm, H. Horn, K. Schuhen, The potential of fluorescent dyes - comparative study of Nile red and three derivatives for the detection of microplastics, Analytical and bioanalytical chemistry 413 (2021) 1059-1071.
- K.D. Cox, G.A. Covernton, H.L. Davies, J.F. Dower, F. Juanes, S.E. Dudas, Human Consumption of Microplastics, Environmental science & technology 53 (2019) 7068-7074.
- S. Primpke, S.H. Christiansen, W. Cowger, H. de Frond, A. Deshpande, M. Fischer, E.B. Holland, M. Meyns, B.A. O'Donnell, B.E. Ossmann, M. Pittroff, G. Sarau, B.M. Scholz-Böttcher, K.J. Wiggin, Critical Assessment of Analytical Methods for the Harmonized and Cost-Efficient Analysis of Microplastics, Applied spectroscopy 74 (2020) 1012-1047.
- W.J. Shim, Y.K. Song, S.H. Hong, M. Jang, Identification and quantification of microplastics using Nile Red staining, Marine Pollution Bulletin 113 (2016) 469-476.
- G. Erni-Cassola, M.I. Gibson, R.C. Thompson, J.A. Christie-Oleza, Lost, but Found with Nile Red: A Novel Method for Detecting and Quantifying Small Microplastics (1 mm to 20 μm) in Environmental Samples, Environmental science & technology 51 (2017) 13641-13648.
- A.B. Labbe, C.R. Bagshaw, L. Uttal, Inexpensive Adaptations of Basic Microscopes for the Identification of Microplastic Contamination Using Polarization and Nile Red Fluorescence Detection, J. Chem. Educ. 97 (2020) 4026-4032.
- J.C. Prata, V. Reis, J.T.V. Matos, J.P. da Costa, A.C. Duarte, T. Rocha-Santos, A new approach for routine quantification of microplastics using Nile Red and automated software (MP-VAT), The Science of the total environment 690 (2019) 1277-1283.
- G. Sancataldo, G. Avellone, V. Vetri, Nile Red lifetime reveals microplastic identity, Environmental science. Processes & impacts 22 (2020) 2266-2275
