16.03.2023
Tüpfelnachweise und Mikrotitrationen im ökologisch orientierten Chemieunterricht
Wolfgang Proske , Schulchemiezentrum
Prof. Volker Wiskamp , Hochschule Darmstadt
Halbmikrotitrationen unter Verwendung einer Tuberkulinspritze als Ersatzbürette zur Bestimmung der Härte von Wasser und seines Chlorid- und Sauerstoffgehaltes sowie qualitative Nachweise von Nitrat und Phosphat im Boden und von Nitrit und Vitamin C in Lebensmitteln werden beschrieben.
Diese gefahrlosen und abfallreduzierten Versuche eignen sich, um Schüler mit der Denk- und Arbeitsweise der Analytischen Chemie vertraut zu machen. Denn das Beurteilen von analytischen Messwerten erlaubt erst eine weitergehende Diskussion über die großen Probleme der Welt wie die Versauerung und Verschmutzung von Ozeanen und Gewässern, Überdüngung von Böden und ausreichende und gesunde Ernährung einer wachsenden Weltbevölkerung.
Klimawandel, Artensterben, Überbevölkerung, Ressourcenverbrauch, Nahrungsmittelknappheit, Umweltverschmutzung, Kriege, Fake-News ... die Welt steckt in einer Metakrise. Die einzelnen Krisen und ihr Zusammenwirken zu verstehen, ist ein wichtiges Bildungsziel. Der Chemieunterricht, und hier insbesondere die Analytische Chemie, kann und muss dazu beitragen, dieses Ziel zu erreichen.
Der Bildungsauftrag der Analytischen Chemie
Über die Erderwärmung kann man nur sprechen, wenn zuverlässige Daten über die CO2-Konzentration in der Atmosphäre vorliegen. Die Versauerung der Ozeane und das Verschwinden von Riffen kann man nur auf der Basis von genauen Messungen des pH-Wertes und der Calciumhydrogencarbonat-Konzentration beurteilen. Die Salzfracht von Abwässern darf man beklagen, wenn man den Salzgehalt bestimmt hat. Um eine Gewässereutrophierung zu beurteilen, muss man Sauerstoffmessungen durchführen.
Ob ein Boden durch übermäßigen Gülle-Austrag überdüngt ist, sagen einem Nitrat- und Phosphat-Messungen. Und Lebensmittel werden ein Öko-Siegel erst verdienen, wenn sich in ihnen kein Pökelsalz nachweisen lässt ... Die Analytische Chemie ist also eine Meta-Wissenschaft, auf deren Basis man erst Fehlentwicklungen erkennen, beheben und Nachhaltigkeit erreichen kann. Wenn junge Menschen bereits im Schulunterricht die Denk- und Arbeitsweise der Analytischen Chemie kennenlernen, werden sie zu mündigen Bürgern, die Leugnern des Klimawandels kein Gehör schenken und auch auf andere Falsch-Nachrichten nicht reinfallen.
Analytisches Denken und Experimentieren - früh geübt
Schülerversuche müssen einfach vorzubereiten und durchzuführen, gefahrlos und (weitgehend) abfallfrei sein und natürlich aussagekräftige Ergebnisse liefern. Die ist bei den im Folgenden beschriebenen Titrationen im Halbmikromaßstab und den Nachweisreaktionen auf einer Tüpfelplatte der Fall.
Die Schüler üben das experimentelle Vorgehen an Referenzproben, die den zu bestimmenden Stoff enthalten, wobei sie die erwartenden Phänomene wie Farbänderungen oder Niederschlagsbildungen erstmals erleben. Parallel dazu führen sie Blindproben durch, bei denen der zu bestimmende Stoff im Analyten fehlt. Schließlich analysieren sie die eigentlichen Proben, bei Titrationen dreimal, um ihr Messergebnis statistisch abzusichern.
Chemische Grundlagen der durchgeführten Analysen
Die theoretischen Hintergründe der durchgeführten Analysen können je nach Klassenstufe und Vorkenntnissen unterschiedlich tief behandelt werden.
Carbonathärte
Die Bestimmung der Carbonathärte erfolgt durch Titration mit einer Salzsäure-Maßlösung. Im pH-Bereich 8.3 (Umschlag von Phenolphthalein) bis 4.3 (Umschlag eines Methylrot/Bromkresolgrün-Mischindikators) laufen folgende Reaktionen ab:
HCO3- + HCl → Cl- + H2O + CO2
Gesamthärte
Bei der Gesamthärte-Bestimmung wird die Summe der Konzentrationen an Magnesium- und Calciumionen im Wasser durch komplexometrische Titration bei pH 10 gegen Erio T bestimmt:
M = Ca, Mg
Calciumgehalt
Der Calciumgehalt alleine wird ermittelt, nachdem das Magnesium mit Natronlauge als Mg(OH)2 ausgefällt wurde. Als calciumspezifischer Indikator dient dabei Calconcarbonsäure.
Chlorid-Bestimmung
Die Chlorid-Bestimmung erfolgt durch Fällungstitration nach Fajans mit einer AgNO3-Maßlösung:
Als Indikator wird gelbgrün fluoreszierendes Dichlorfluoreszein verwendet, das sich nach Überschreiten des Äquivalenzpunktes an den durch überschüssige Silberionen positiv geladenen kolloidalen AgCl-Niederschlag anlagert, wodurch dieser eine rosaorange, aber nicht fluoreszierende Farbe annimmt.
Gelöster Sauerstoff
Die Bestimmung von im Wasser gelösten Sauerstoff nach Winkler beruht auf einer Folge von Redoxreaktionen. Zunächst oxidiert der Sauerstoff zugesetztes zweiwertiges Mangan im alkalischen Medium zum vierwertigen. Beim Ansäuern komproportioniert der gebildete Braunstein mit überschüssigem zweiwertigen Mangan zum dreiwertigen, welches zugesetztes Iodid zu elementarem Iod oxidiert:
MnO(OH)2 + Mn2+ + 4 H+ → 2 Mn3+ + 3 H2O
2 Mn3+ + 2 I- → 2 Mn2+ + I2
Die entstandene Menge Iod korrespondiert also mit der ursprünglich im Wasser vorhandenen Menge Sauerstoff und kann mit einer Thiosulfat-Maßlösung titrimetrisch erfasst werden:
Nachweis von Nitrit und Nitrat
Der Nachweis von Nitrit im Boden bzw. in einem Lebensmittel erfolgt in einem wässrigen Extrakt mit Sulfanilsäure und Naphthylethylendiamin, der Nachweis von Nitrat unter Zusatz von Magnesium als Reduktionsmittel. Über die Zwischenstufe eines Diazoniumsalzes bildet sich ein rotvioletter Azofarbstoff (Abbildung 1).
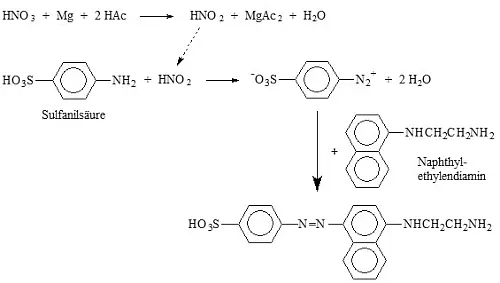
Abb.1: Nachweis von Nitrit bzw. Nitrat (nach Reduktion zu Nitrit) als rotvioletter Azofarbstoff
Phosphatnachweis
Der Nachweis von Phosphat im Boden bzw. in einem Lebensmittel erfolgt in einem wässrigen Extrakt als gelbe Heteropolysäure:
Deren Ausfallen ist allerdings nur bei einer hohen Phosphat-Konzentration und nach Erhitzen zu beobachten. In Gegenwart eines Reduktionsmittels (hier zugesetztes Zinn(II)-chlorid) gehen aber selbst kleinste Menge der Heteropolysäure in Molydän-Blau über, eine kolloidale Verbindung der Zusammensetzung MoxOy(OH)z, in der sich die Oxidationsstufe des Metalls zwischen 5 und 6 bewegt.
Nachweis von Ascorbinsäure
Als Reduktionsmittel gegenüber der Heteropolysäure kann auch Vitamin C fungieren, das in vielen Lebensmitteln als Antioxidans eingesetzt wird. So lässt sich auch ein Nachweis von Ascorbinsäure nach folgender vereinfachter Reaktionsgleichung bewerkstelligen:
Experimenteller Teil
Indikatoren, Maßlösungen, Tüpfelreagenzien und sonstige Hilfsreagenzien werden vor dem Unterricht von den Lehrkräften im Chemikalienhandel bestellt bzw. zubereitet und sind meistens lange haltbar.
Mikrotitrationen
- Abb.2: Tuberkulinspritze als Ersatzbürette
für Titrationen im Halbmikromaßstab [1].
Bestimmung der Carbonathärte:
Mit einer Injektions- oder Fortunaspritze werden 10 ml Wasserprobe gezogen, in einen 25-ml-Erlenmeyerkolben gegeben und mit 1 Tropfen Phenolphthalein-Lösung (w = 1 % in Ethanol) versetzt. Falls die Probe rot wird, muss durch langsames Zutropfen von HCl (c = 0,1 mol/l) gerade entfärbt werden, bevor 2 Tropfen Mischindikator nach Cooper (20 mg Methylrot und 100 mg Bromkresolgrün in 100 ml Ethanol) zugesetzt werden. (Bleibt die Probe bei der Phenolphthalein-Zugabe farblos, kann der Mischindikator sofort zugesetzt werden.) Jetzt erfolgt die eigentliche Titration mit Salzsäure (c = 0,1 mol/l) bis zum Farbumschlag von Blau nach Rot. 1 ml Salzsäure (c = 0,1 mol/l) entspricht 2,8 Grad Deutscher Härte (1 Grad Deutscher Härte = 10 mg CaO pro Liter).
Bestimmung der Gesamthärte:
10 ml Wasserprobe werden mit einer halben Indikator/Puffer-Tablette oder einer Spatelspitze Indikator/Puffer-Verreibung (hergestellt aus 0,2 g Methylorange, 0,5 g Eriochromschwarz T, 5 g Magnesiumsalz des EDTA und 195 g Ammoniumchlorid) und mit 10 Tropfen Ammoniak-Lösung (w = 25 %) versetzt und mit einer EDTA-Lösung (c = 0,1 mol/l) bis zum Farbumschlag von Rot nach Grün titriert. 1 ml EDTA-Lösung (c = 0,1 mol/l) entspricht 5,6 Grad Deutscher Härte.
Bestimmung von Chlorid:
10 ml Wasserprobe werden mit 2 Tropfen Dichlorfluoreszein-Lösung (0,2 g Dichlorfluoreszein in 100 ml Ethanol oder 0,2 g Dichlorfluoreszein-Natriumsalz in 100 ml Wasser) versetzt und mit Silbernitrat-Lösung (c = 0,1 mol/l) titriert, bis sich der Niederschlag von gelbgrün (fluoreszierend) nach rosaorange (nicht fluoreszierend) verfärbt. 1 ml Silbernitrat-Lösung (c = 0,1 mol/l) entspricht 3,54 mg Cl-.
Bestimmung von Sauerstoff:
Eine 50-mL Enghalsflasche wird unter Wasser komplett gefüllt, wobei darauf zu achten ist, dass keine Luftblasen eingeschlossen werden. Ebenfalls unter Wasser werden nacheinander 5 Tropfen Mangan(II)-chlorid-Lösung (40 g MnCl2·4 H2O in 100 ml Wasser) und 5 Tropfen alkalische Kaliumiodid-Lösung (18 g NaOH und 30 g KI zu 100 ml lösen) in die Flasche getropft. (Die Lösungen sind schwerer als Wasser und bleiben daher kurzzeitig am Boden des Gefäßes, wenn die verwendete Pipette so tief in dieses eingetaucht wird. Bei diesem Arbeitsvorgang ist darauf zu achten, dass keine Luftblasen in die Flasche eingeschleust werden). Der Stopfen wird schnell aufgesetzt. Dann wird gut gemischt, bis sich ein mehr oder weniger stark brauner Niederschlag gebildet hat. Man lässt diesen im unteren Drittel der Flasche absitzen, öffnet diese kurz und gibt 10 Tropfen Mischsäure (200 ml Wasser, 25 ml konzentrierte H3PO4, 25 ml konzentrierte H2SO4) zu, verschließt die Flasche schnell wieder, schüttelt um und wartet, bis der Flascheninhalt völlig klar ist. (Jetzt ist die Reaktionslösung nicht mehr luftempfindlich.) Man entnimmt der Flasche eine 5-ml-Probe (Messzylinder-Genauigkeit reicht hier aus) und spült sie mit etwas destilliertem Wasser in einen 25-ml-Erlenmeyerkolben, setzt 2 Tropfen Stärke-Lösung (frisch bereitet durch Aufkochen von Stärke in Wasser) oder ZnI2/Stärke-Lösung zu und titriert mit Thiosulfat-Lösung (c = 0,01 mol/l), bis die tiefblaue Lösung farblos wird. 1 ml Thiosulfat-Lösung (c = 0,01 mol/l) entspricht 0,08 mg O2.
Qualitative Nachweise auf der Tüpfelrasterplatte

- Abb.3: Tüpfelraster-Platten für die
qualitative Mikroanalytik [1].
Für qualitative Nachweisreaktionen werden Tüpfelrasterplatten (Abbildung 3) [1] verwendet. Von der Analyt-Lösung werden 1-2 Tropfen auf ein Feld der Platte getropft. Dann wird ein Nachweisreagenz zugegeben, worauf eine Farbreaktion einsetzt oder ein Niederschlag entsteht (Abbildung 4).
Probenvorbereitung
Zunächst werden wässrige Extrakte der zu untersuchenden Böden bzw. Lebensmittel hergestellt. Diese werden für die einzelnen Nachweisreaktionen verwendet.
Ein Bodenextrakt wird gewonnen, indem ca. 0,5 g (ein gehäufter Spatel) trockener Boden in einem Reagenzglas mit Stopfen oder einem Schnappdeckelglas mit 5 ml destilliertem Wasser kräftig geschüttelt wird, gefolgt von einer Filtration.
Ein Wurstextrakt bzw. ein Extrakt von veganem Bio-Wurstersatz wird erzeugt, indem ca. 1 g Wurst (nitrit- und phosphathaltig) bzw. veganer Bio-Wurstersatz (Vitamin C-haltig) in kleine Stücke geschnitten und in einem Becherglas mit 10 ml destilliertem Wasser kurz aufgekocht wird. Nach dem Abkühlen wird filtriert. Von einer Bockwurstkonserve kann die Aufguss-Flüssigkeit direkt verwendet werden.
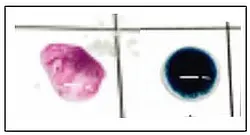
- Abb.4: Tüpfelanalytik. Nachweis von Nitrit/
Nitrat als rotvioletter Azofarbstoff (links)
und von Phosphat als Molybdän-Blau
(rechts) [2].
Nachweis von Nitrit:
2 Tropfen des auf Nitrit zu prüfenden Extrakts (bzw. einer Kaliumnitrit-Lösung (w = 1 %) zum Vergleich) werden auf einer Tüpfelplatte mit einem Tropfen Essigsäure (w = 25 %) angesäuert. Man gibt eine Mikrospatelspitze Nitritreagenz (0,3 g Naphthylethylendiammoniumchlorid, 1,5 g Sulfanilsäure und 100 g Natriumchlorid werden sorgfältig miteinander in einer Reibschale verrieben; das Reagenz wird in einer Braunglasflasche gut verschlossen aufbewahrt und trocken gelagert) hinzu. Bei Anwesenheit von Nitrit färbt sich die Mischung nach 1-2 Minuten rotviolett. Bei einer hohen Nitrit-Konzentrationen tritt schnell ein Farbumschlag nach braun auf.
Nachweis von Nitrat:
2 Tropfen des auf Nitrat zu prüfenden Extrakts (bzw. einer Kaliumnitrat-Lösung (w = 1 %) zum Vergleich) werden auf einer Tüpfelplatte mit einem Tropfen Essigsäure angesäuert. Es wird ein Magnesiumspan dazu gegeben. Nach zwei Minuten entfernt man diesen und gibt eine Mikrospatelspitze Nitritreagenz hinzu. Bei Anwesenheit von Nitrat färbt sich die Mischung nach 1-2 Minuten rotviolett. Bei einer hohen Nitrat-Konzentrationen tritt schnell ein Farbumschlag nach braun auf.
Nachweis von Phosphat:
2 Tropfen des auf Phosphat zu prüfenden Extrakts (bzw. einer Kaliumdihydrogenphosphat-Lösung (w = 1 %) zum Vergleich) werden auf einer Tüpfelplatte mit einem Tropfen Ammoniummolybdat-Lösung (2,5 g Ammoniummolybdat werden in 100 ml Wasser gelöst und mit 16,5 ml konzentrierter Schwefelsäure versetzt; dann wird mit Wasser auf ein Gesamtvolumen von 250 ml aufgefüllt) versetzt. Bei hoher Phosphat-Konzentration bildet sich ein gelber Niederschlag, bei niedriger Phosphatkonzentration ist er aber kaum zu erkennen, sodass 1 Tropfen Zinn(II)-chlorid-Lösung (2,5 g Zinn(II)-chlorid-Dihydrat werden in 100 ml Glycerin gelöst) zugefügt wird. Eine dann auftretende Blaufärbung bestätigt das Vorliegen selbst kleiner Phosphat-Mengen.
Nachweis von Ascorbinsäure:
2 Tropfen des Extrakts von veganem Bio-Wurstersatz (bzw. einer Ascorbinsäure-Lösung (w = 1 %, nicht lange haltbar) zum Vergleich) werden auf einer Tüpfelplatte mit einem Tropfen Kaliumdihydrogenphosphat-Lösung (w = 1 %) sowie einem Tropfen schwefelsaurer Ammoniummolybdat-Lösung versetzt. Eine Blaufärbung belegt das Vorliegen eines Reduktionsmittels, welches bei einem veganen Bio-Wurstersatz Vitamin C ist.
Ökologischer Bezug der durchgeführten Analysen
Welche Bezüge zu ökologischen Problemen lassen sich mit den durchgeführten Schülerexperimenten herstellen?
Carbonat/Hydrogencarbonat/Calcium-Bestimmung:
Die Ozeane versauern durch immer mehr aus der Luft aufgenommenes Treibhausgas Kohlenstoffdioxid. Kohlensäure löst das im Exoskelett von Schalentieren enthaltene Calciumcarbonat zu Calciumhydrogencarbonat auf,
was ein Artensterben zur Folge hat. Der pH-Wert des Meerwassers sinkt, und der Gehalt an Hydrogencarbonat und Calcium steigt, was analytisch verfolgt werden muss.
Chlorid-Bestimmung:
Sauer und alkalische Abwässer aus der Industrie werden zwar (hoffentlich) neutralisiert, bevor sie in natürliche Gewässer einfließen, sind dann aber aufgesalzt. Ihr Salzgehalt muss kontrolliert werden, damit er toxische Höchstwerte nicht überschreitet.
Nitrat- und Phosphat-Nachweise:
Pflanzen brauchen Dünger, keine Frage. Aber ein Zuviel an Nitrat und Phosphat, welches insbesondere in Form von Gülle aus der Massentierhaltung in die Böden und von dort ins Grundwasser oder in Fließgewässer und schließlich ins Meer gelangt bzw. über die Nutzpflanzen auch auf unseren Tisch, stellt ein zunehmendes (öko)toxikologisches Problem dar. Grenzwerte dürfen auf keinen Fall überschritten werden, was analytisch zu überprüfen ist.
Sauerstoff-Bestimmung:
Eine Folge der Überdüngung ist die Eutrophierung von Gewässern. Insbesondere Algen vermehren sich aufgrund des großen Nahrungsangebots, zehren dabei gleichzeitig von dem im Wasser gelösten Sauerstoff, der dann z.B. den Fischen fehlt. Unterstützt wird die Abnahme des Sauerstoffgehalts durch die Erwärmung der Gewässer als Folge des Treibhauseffektes. Also ist die analytische Sauerstoff-Bestimmung im Wasser besonders wichtig.
Nitrit- und Ascorbinsäure-Nachweise:
Wurst aus der allein schon aus ethischen Gründen zu verurteilenden Massentierhaltung wird fast immer mit kleinen Mengen Nitrit (Pökelsalz) konserviert. Dieses wirkt als Methämoglobinbildner (Oxidation des zweiwertigen Eisens im Hämoglobin zum dreiwertigen, das keinen Sauersoff mehr transportieren kann) und bildet kanzerogene Nitrosamine an lebenswichtigen aminischen Gruppen von Biomolekülen:
Bio∼NRH + NO2- + H+ → Bio∼NR-N=O + H2O
Veganer Bio-Wurstersatz, z.B. Tofu-Würstchen, erhalten hingegen kein Nitrit. Ihnen wird als Konservierungsmittel (Antioxidanz) meistens Ascorbinsäure zugesetzt. Dieses ist aber gleichzeitig ein für uns Menschen nützliches Vitamin. An die Nachweisreaktionen von Nitrit und Ascorbinsäure wird sich die Diskussion um Nahrungsmitteladditive und einen gesünderen und nachhaltigeren Ernährungsstil automatisch anschließen.
Für viele weitere Beispiele zum sicheren und umweltfreundlichen Experimentieren sowie zur Thematisierung der globalen Meta-Krise aus dem Blickwinkel der Chemie sei auf die Literatur verwiesen, z.B. [1-4 bzw. 5-10].
Literatur
- M. Schwab: Fachreferent Chemie (abgerufen am 5.3.2023)
- W. Proske, M. Schwab: Tüpfelanalytik - Nachweisreaktionen von Kationen und Anionen in Alltagsprodukten. - Praxis der Naturwissenschaften/Chemie in der Schule PdN ChiS 64 (2015), Heft 7, S. 14-22
- W. Proske, V. Wiskamp: Tipps und Tricks für einen gefahrlos(er)en Chemieunterricht. - Aulis Verlag Deubner, Köln 2008
- R. Kickuth, R. Stephani (Hrsg.): Viktor Obendraufs schöne Experimente. - Band 1: Labor & Theorie, Bildung & Unterhaltung; Band 2: Industrie & Anwendung, Haushalt & Natur. - Verlag Rubikon Rolf Kickuth, Gaiberg 2015/2016
- V. Wiskamp: Die globale Metakrise aus dem Blickwinkel der Chemie - Vorschläge für Seminare und Projektarbeiten. - Books on Demand (BoD), Norderstedt 2021
- V. Wiskamp: "Geh' mir aus der Sonne" - Das Ökologische Manifest - 95 Thesen - Chemie-Lehrende aller Länder, vereinigt euch! - Books on Demand (BoD), Norderstedt 2021
- V. Wiskamp: Vom Anthropozän ins Symbiozän - Eine virtuelle Museumsausstellung mit Begleitseminar. - Books on Demand (BoD), Norderstedt 2021
- V. Wiskamp: Chemie und Nachhaltigkeit - Eine Chemie-Vorlesung für Studierende der Nicht-MINT-Fächer. - Books on Demand (BoD), Norderstedt 2022
- V. Wiskamp (Hrsg.), P. Shoghian, M. Ben Nticha, M. M'hamdi Alaoui, K. Lemalmi, H. Moradi, M. Ben Hamouda, H. Bark und N. Brosch: Leben zwischen Kampf und Kooperation - Eine chemiedidaktische Reflexion. - Books on Demand (BoD), Norderstedt 2022
- P. T. Anastas, J. C. Warner: Green Chemistry - Theory and Practise. - Oxford University Press, New York 1998 (als Paperback 2000)
